Il virus è un’entità biologica che non è in grado di replicarsi in maniera autonoma. Necessita infatti di una cellula ospite ed è per questo che gli viene conferita la definizione di parassita obbligato. All’interno delle nostre cellule sono presenti ribosomi, enzimi e altre molecole che il virus non è in grado di produrre, ma che riesce ad utilizzare, una volta entrato. Nella cellula il virus trova un ambiente favorevole che gli consente, attraverso una serie di reazioni specifiche, di copiare le proprie informazioni genetiche, tradurle in proteine virali e ottenere, tramite l’assemblaggio di queste stesse proteine, tante copie di se stesso.
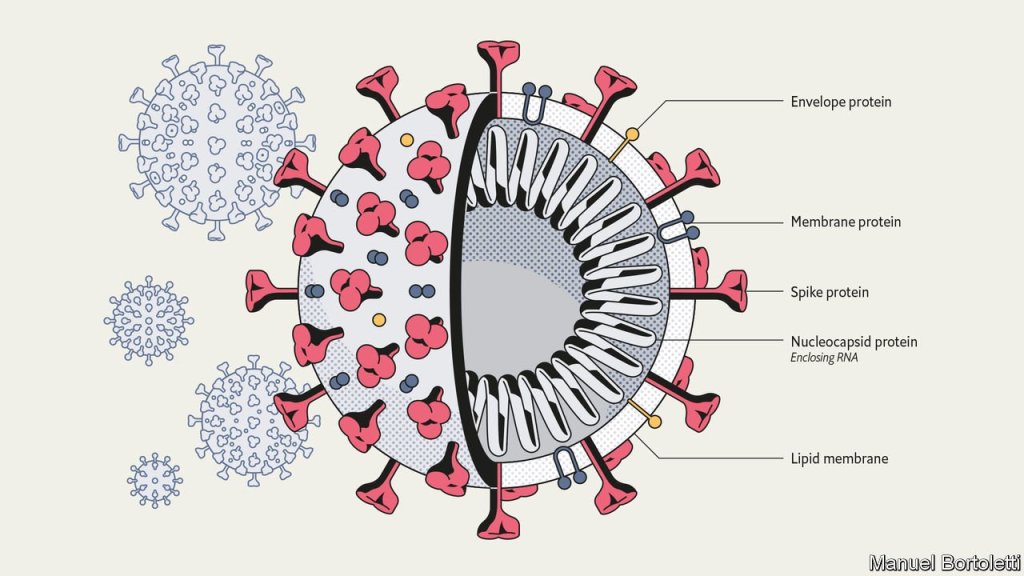
Per poter entrare, il virus sfrutta gli stessi meccanismi di riconoscimento che sono già esistenti nell’organismo ospite. Solitamente utilizza come “porta di ingresso” un recettore sulla membrana della cellula che, in condizioni normali, è deputato ovviamente ad altre funzioni.
L’interazione tra un qualsiasi recettore di membrana e una molecola (per esempio un ormone o un neurotrasmettitore) è molto raffinata ed è la base su cui vengono espletate tutte le più importanti funzioni dell’organismo. Di conseguenza, il virus deve necessariamente imitare la molecola specifica per quel preciso recettore, in modo altrettanto accurato. Questo è possibile grazie alla presenza di specifiche proteine virali, esposte sulla superficie del virus, che interagiscono col recettore di membrana della cellula ospite come farebbe la molecola endogena (prodotta dall’organismo), causando l’innesco di una serie di reazioni a catena che avranno come fine l’internalizzazione dell’acido nucleico del virus (DNA o RNA) all’interno della cellula. Queste proteine virali esposte prendono anche il nome di anti-recettore. La chiave del meccanismo di infezione quindi risiede proprio nell’interazione tra il recettore di membrana della cellula ospite e l’anti-recettore del virus. Una qualsiasi mutazione a carico della proteina anti-recettore del virus potrebbe alterare questo legame, rendendolo più o meno probabile.
Infatti, dato che i virus cercano di ottenere tante copie di se stessi nel più breve arco di tempo possibile, essi mutano molto velocemente per mantenersi in equilibrio con il sistema immunitario dell’ospite. Eventi di riassortimento o ricombinazione genetica si verificano molto frequentemente, sia che il virus sia a DNA o a RNA. L’RNA però è una molecola molto più instabile del DNA, pertanto la probabilità di mutazione in un virus a RNA è più alta.
Il virus può dunque mutare da persona a persona e una stessa specie virale può possedere tante piccole varianti di se stessa che permettono la diffusione del virus all’interno della popolazione. L’elevata variabilità genetica offre al virus anche la possibilità di reinfettare una persona guarita, presentandosi al sistema immunitario come una variante del virus precedentemente incontrato (questo accade, per esempio, nel caso del virus influenzale).
La maggior parte delle mutazioni sono silenti, non comportano cioè un cambiamento importante della proteina per la quale il gene codifica. Se invece la mutazione induce la traduzione di proteine diverse da quelle del virus iniziale, ecco che può emergere un nuovo virus.
In base alla funzione della proteina codificata dal gene mutato, si possono avere differenti effetti.
Che cosa accade quando la proteina mutata è proprio l’anti-recettore del virus?
In questo caso viene alterato il meccanismo di interazione tra virus e cellula ospite, per cui il virus diventerà adatto a legarsi ad un nuovo tipo di cellula, per esempio quella di un’altra specie. Questo fenomeno è quello accaduto durante lo spillover del SARS-CoV-2 ed è definito “salto di specie” del virus.
Il progenitore del SARS-CoV-2 è infatti probabilmente un virus del pipistrello, nel quale è stata riscontrata un’identità genetica del 96%. Non sembra dunque derivare dal SARS-CoV (virus identificato come agente eziologico della SARS nel 2003), con cui condivide un’identità genetica del 79,6%, sebbene le loro storie e caratteristiche evolutive siano molto simili tra loro.
In entrambi i casi, il virus si è evoluto a partire dal suo serbatoio naturale (il pipistrello), per passare da un ospite intermedio (ad oggi ancora da individuare), così da raggiungere l’ospite definitivo: l’uomo.
È chiaro che non esiste alcuna forma di finalismo in realtà in questo fenomeno: semplicemente il virus, accidentalmente mutato, si è trovato casualmente in condizioni estremamente favorevoli, che gli hanno consentito di infettare le cellule umane.
La mutazione che ha permesso il salto di specie da animale a uomo in questi due Coronavirus è quella avvenuta a carico del gene che codifica per la glicoproteina Spike. Questa non è altro che l’anti-recettore, che interagisce col recettore di membrana ACE2, presente in particolare nelle cellule a livello dell’epitelio polmonare.
ACE2 (Angiotensin Converting Enzyme – 2) è infatti associato alla formazione di angiotensina 1-7 (clicca qui se sei interessato ad approfondire il ruolo dell’angiotensina 1-7), un ormone che determina vasodilatazione e contribuisce all’abbassamento della pressione arteriosa. Il numero di recettori esposti sulla membrana cellulare può variare da individuo a individuo, per ragioni sia genetiche che cliniche. A tale proposito, è stata documentata un’aumentata espressione del gene che codifica per ACE2 nei pazienti umani trattati con farmaci normalmente prescritti come terapia anti- ipertensiva. Pertanto questi individui presenterebbero più “porte d’ingresso” per il virus. Poiché l’ipertensione è una condizione clinica molto diffusa nei paesi industrializzati, questo potrebbe rappresentare un ulteriore vantaggio per il virus, che troverebbe così molti ospiti suscettibili all’infezione, specialmente oltre i 50 anni di età.
Perché il SARS-CoV-2 risulta così aggressivo?
Molti Coronavirus coesistono da molti anni con l’essere umano, senza comportare problemi significativi. L’incontro tra quest’ultimo virus e il nostro sistema immunitario però è avvenuto di recente, pertanto non c’è ancora stato un vero adattamento. Il virus infatti ha come unico imperativo quello di replicarsi e un equilibrio col nostro organismo gli permetterebbe di poterlo sfruttare per un più lungo arco di tempo, senza scatenare forti reazioni. Pensiamo ad esempio a quanto sia facile contrarre e diffondere un semplice raffreddore. Esiste dunque una pressione selettiva che favorisce le varianti del virus meno aggressive e più efficaci da un punto di vista replicativo.
Quello che è da tenere presente però è che questi meccanismi evolutivi non sono prevedibili. Pertanto non è possibile stabilire con certezza se e quando questo virus troverà un equilibrio con l’essere umano.
Alcuni virus infatti effettuano il salto di specie per poi “tornare” al proprio serbatoio naturale. In quest’ottica è fondamentale limitare qualsiasi contatto tra di noi in questo momento, nella speranza di alleggerire il nostro sistema sanitario e contemporaneamente di limitare il passaggio del virus da un individuo all’altro. Senza ospiti, il virus non può replicarsi!
È possibile limitare l’eventualità che altri virus effettuino il salto di specie animale-uomo?
I coronavirus hanno causato due pandemie su larga scala negli ultimi due decenni, la SARS e la sindrome respiratoria del Medio Oriente (MERS). Questi, esattamente come il SARS-CoV-2, si sono evoluti in corrispondenza di mercati in cui erano presenti animali esotici, sia vivi che morti.
Tenere assieme tanti animali diversi, in condizioni igieniche pessime, facilita la diffusione di qualsiasi virus, aumentando la probabilità che, ad ogni ciclo replicativo, avvenga una mutazione che favorisca il passaggio del virus da una specie all’altra.
In secondo luogo, la distruzione degli habitat è un ulteriore fattore che ci espone ad essere infettati da virus tipici di specie divenute minacciate. Infine, il nostro stesso stile di vita, per cui viviamo in posti affollati e raggiungiamo facilmente qualsiasi città del mondo in poche ore, ci rende un ospite perfetto per diffondersi. Per questo oggi una qualsiasi epidemia può degenerare molto facilmente in pandemia.
Possiamo quindi:
- Migliorare le condizioni igieniche degli allevamenti di animali (e dei mercati)
- Preservare il più possibile gli ecosistemi
- Attenerci scrupolosamente alle regole previste per la pandemia di SARS-CoV-2 in corso
- Donare fondi alla ricerca scientifica

Bibliografia:
- Benvenuto D., Giovanetti M., Ciccozzi A., Spoto S., Angeletti S., Ciccozzi M. (2020) The 2019‐new coronavirus epidemic: Evidence for virus evolution. Journal of Medical Virology 92:455–459
- Cao Y., Li L., Feng Z., Wan S., Huang P., Sun X., Wen F., Huang X., Ning G., Wang W., (2020) Comparative genetic analysis of the novel coronavirus (2019-nCoV/SARS-CoV-2) receptor ACE2 in different populations. Cell Discovery (2020)6:11
- Gorbalenya A. E., Baker S. C., Barci R. S., De Groot R. J., Drosten C., Gulyaeva A. A., Haagmans B. L., Lauber C., Leontovich A. M., Neuman B. W., Penzar D., Perlman S., Poon L. L. M., Samborskiy D. V., Sidorov I. A., Sola I., Ziebuhr J. (2020) The species Severe acute respiratory syndrome-related coronavirus: classifying 2019-nCoV and naming it SARS-CoV-2. Nature Microbiology
- Lu R., Zhao X., Li J., Niu P., Yang B., Wu H., Wang W., Song H., Huang B., Zhu N., Bi Y., Ma X., Zhan F., Wang L., Hu T., Zhou H., Hu Z., Zhou W., Zhao L., Chen J., Meng Y, Wang J., Lin Y., Yuan J., Xie Z., Ma J., Liu W. J., Wang D., Xu W., Holmes E. C., Gao G. F., Wu G., Chen W, Shi W., Tan W. (2020) Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding, Lancet 395:565-74
- Zhou P., Yang X., Wang X., Hu B., Zhang L., Zhang W., Si H., Zhu Y., Li B., Huang C., Chen H., Chen J., Luo Y., Guo H., Jiang R., Liu M., Chen Y., Shen X., Wang X., Zheng X., Zhao K., Chen Q., Deng F., Liu L., Yan B., Zhan F., Wang Y., Xiao G., Shi Z. (2020) A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature 579:270–273


Di una chiarezza esemplare. Complimenti!
"Mi piace"Piace a 1 persona
Sono lusingata, grazie!
"Mi piace""Mi piace"