L’autocontrollo, il dominio di sé, il coordinamento dei propri stimoli e delle proprie azioni: sono tutte definizioni che esercitano su di noi un forte fascino. Innumerevoli sono i metodi pubblicizzati per acquisire un maggiore autocontrollo, in un’epoca che ci vede costantemente divisi tra la ricerca di uno stile di vita più equilibrato e la tendenza a vivere ogni piacere senza moderazione.
In un’ottica psicoevolutiva, si potrebbe pensare che la sregolatezza sia un tratto antico da cui oggi cerchiamo di emanciparci attraverso il dominio di noi stessi, per raggiungere una forma “più evoluta” e meno impulsiva di H. sapiens. In realtà, l’autocontrollo è un’abilità ambita già dai tempi di Omero: ricordiamo tutti Ulisse che, consapevole della sua incapacità di resistere al canto delle sirene, decide di farsi legare all’albero maestro della nave, come strategia per non cedere ai propri impulsi.
«Prima a evitare ci esortava il canto
delle dolci Sirene e il prato in fiore,e mi ordinò che le ascoltassi io solo;
ma voi con salde funi a piè dell’albero
legatemi, ch’io resti dritto e fermo:
forte annodate i canapi; e se io pregoe vi impongo di sciogliermi, stringetemi
Omero, Odissea, Canto XII (VI secolo a.C. )
senza pietà con nodi anche più fitti.»
Da dove origina allora questo comportamento? È davvero necessario imparare una serie di tecniche, per poterlo sviluppare?
Per quanto agli adulti possa a volte risultare davvero difficile resistere alle tentazioni, il self-control è un tratto già presente in età prescolare. Nel 1970, lo psicologo Walter Mischel sviluppò il Marshmallow Test per valutare questa capacità in bambini tra i 4 e i 5 anni. I bambini venivano messi di fronte ad una scelta: attendere una ricompensa per un certo arco di tempo oppure ottenerne una meno gradita immediatamente. In questo modo, Mischel definì l’autocontrollo come la capacità di rinunciare ad una gratificazione immediata, in prospettiva di una ricompensa migliore in futuro.

Nel test classico, al bambino viene dato un marshmallow, spiegandogli che potrebbe averne un secondo, se attende il ritorno dello sperimentatore, senza mangiare quello che ha davanti. Il bambino viene lasciato da solo in una stanza e può scegliere liberamente. Il grado di autocontrollo viene misurato in base al tempo massimo che il bambino riesce ad aspettare, prima di cedere e mangiare il marshmallow. È interessante notare che i bambini che riescono a sostenere il punteggio massimo di 20 minuti sembrano mettere spontaneamente in atto delle tecniche di autodistrazione, di modo da evitare il focus sull’oggetto desiderato: si coprono ad esempio gli occhi, cantano, inventano giochi con mani e piedi e qualcuno cerca perfino di addormentarsi (link al video di un marshmallow test).
Distogliere quindi l’attenzione dalla ricompensa immediata, pur mantenendo il comportamento diretto verso l’obiettivo, può essere una chiave per riempire il tempo di attesa per la ricompensa preferita.
Questo studio ha mostrato che il self-control è una capacità che può essere appresa e migliorata, ma possiede prima di tutto una componente innata. Richiede:
• Processi decisionali;
• Comportamenti orientati ad un obiettivo;
• Capacità di pianificare il futuro.
Successivi studi di follow-up hanno infatti permesso di valutare che i bambini che mostrano i punteggi più alti in termini di autocontrollo, possiedono prestazioni cognitive e sociali migliori degli altri durante l’adolescenza e l’età adulta.
È facile quindi cadere nella trappola antropocentrica del pensare che un comportamento così complesso sia esclusivo dell’essere umano. Se però cerchiamo di comprendere le origini dell’autocontrollo, ci accorgiamo che è presente in molte altre specie.
L’aspetto forse più importante è che, come altri tratti comportamentali, l’evoluzione di questa abilità cognitiva non segue un percorso filogenetico, ma varia attraverso i differenti taxa. I fattori che sembrano essere coinvolti nello sviluppo di questa capacità sono:
•Tipo di metabolismo e aspettativa di vita: si riscontra in specie che possiedono un metabolismo lento e un’elevata aspettativa di vita (es.: scimpanzé, corvidi, pappagalli).
•Fattori socio-ecologici: specie sociali che cooperano per la sopravvivenza possono mostrare un maggiore autocontrollo, condividendo ad esempio il proprio cibo con i conspecifici, nell’ottica di ricevere lo stesso comportamento in un secondo momento.
•Dieta: specie specialiste possono mostrare elevato self-control, attendendo il momento più adatto per il foraggiamento.
Attualmente è però difficile comprendere la singola importanza di questi fattori, poiché molte delle specie ad oggi studiate affrontano sfide socio-ecologiche analoghe e condividono caratteristiche simili.
Per questo motivo, il gruppo di Schnell ha recentemente indagato sull’esistenza di questa abilità in Sepia officinalis, un cefalopode che possiede dei tratti eco-etologici differenti, rispetto alle specie studiate in precedenza:
• Metabolismo veloce;
• Vita tipicamente inferiore ai 2 anni;
• Socialità semplice, che non richiede cooperazione.
Si tratta di un invertebrato che mostra però comportamenti anche molto complessi.
Innanzitutto, la dieta di questi molluschi richiede lunghi periodi di esplorazione per localizzare e catturare le prede. Questo aspetto probabilmente ha portato all’evoluzione di una spiccata capacità di apprendimento, specialmente a livello spaziale (Alves et al., 2007). In effetti, recenti studi mostrano come durante il sonno di questo animale sia presente un’attività neurale simile a quella della fase REM (Rapid Eye Movement) dell’essere umano, durante la quale avviene il consolidamento della memoria (Iglesias et al., 2019).

L’esistenza di una forma di memoria a lungo termine, l’episodic-like memory, consentirebbe di mettere in atto strategie di predazione orientate al futuro, poiché permetterebbe alle seppie di ricordare non soltanto una particolare circostanza, ma anche dove e quando si è verificata (Jozet-Alves et al., 2013).
Questa capacità conferisce un’elevata plasticità comportamentale, che permette alle seppie di modificare il foraggiamento, in risposta alle mutevoli condizioni ambientali.
I processi decisionali coinvolti durante la predazione infatti comprendono non solo quando e dove spostarsi, ma anche la colorazione da assumere in base alle circostanze: le seppie sono in grado di utilizzare gli stimoli visivi per riprodurre il pattern del fondale o un particolare riflesso della luce, attraverso la disruptive coloration, una forma di mimetismo in cui la sagoma dell’individuo viene spezzata, combinando colori contrastanti tra loro (Chiao et al., 2007).

Persiste però un interrogativo non di poco conto: come si applica il paradigma sperimentale del Marshmallow Test in un cefalopode?
Per prima cosa, il team di ricerca ha svolto dei test per valutare quale fosse la preda favorita nei diversi individui subadulti oggetto di studio. È emersa una significativa preferenza generale per il gambero vivo, che viene quindi reso disponibile in un tempo successivo; la preda immediatamente disponibile è invece il gambero crudo, secondo in termini di scelta. Come nel test originale, il tempo rappresenta l’unità di misura per valutare la capacità di autocontrollo degli individui (Schnell et al., 2021).

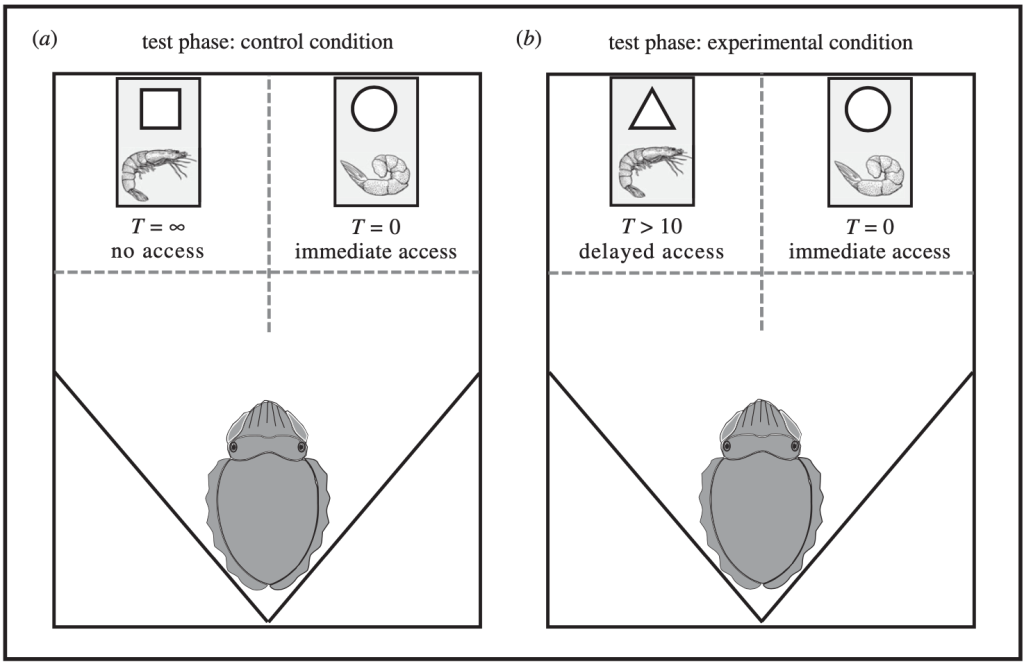
L’apparato sperimentale è costituito da 2 camere con porte scorrevoli trasparenti, di modo da rendere il contenuto visibile alla seppia, che viene posta equidistante rispetto alle 2 camere. Ciascuna camera è di volta in volta contrassegnata con uno specifico simbolo, associato al tipo di accessibilità alla camera:
• cerchio: accessibilità immediata;
• triangolo: accesso ritardato;
• quadrato: nessuna accessibilità.
L’esperimento si compone di 4 fasi principali:
- Fase di formazione I: si insegna alla seppia ad associare il simbolo visivo al tipo di accessibilità alla camera.
- Fase di formazione II: la seppia apprende che una volta effettuata la scelta, la preda nell’altra camera viene immediatamente rimossa.
Durante entrambe le fasi di formazione, gli sperimentatori hanno evitato il sovrallenamento degli individui, escludendo così l’insorgenza di comportamenti dovuti a fenomeni di abitudine. - Fase di pre-test: aumento consecutivo della durata del ritardo per la preda favorita (dai 2 ai 20 secondi).
- Fase di test: divisa in una condizione di controllo e una sperimentale. Nella prima, la seppie deve scegliere tra una preda non preferita immediata e una preferita ma non ottenibile. Questa condizione è importantissima, perché permette di valutare che la scelta della seppia sia dipendente dal contesto e non dovuta ad abituazione. Nella condizione sperimentale invece, la seppia deve scegliere tra un gambero crudo ottenibile da subito e un gambero vivo disponibile dopo un certo arco di tempo.
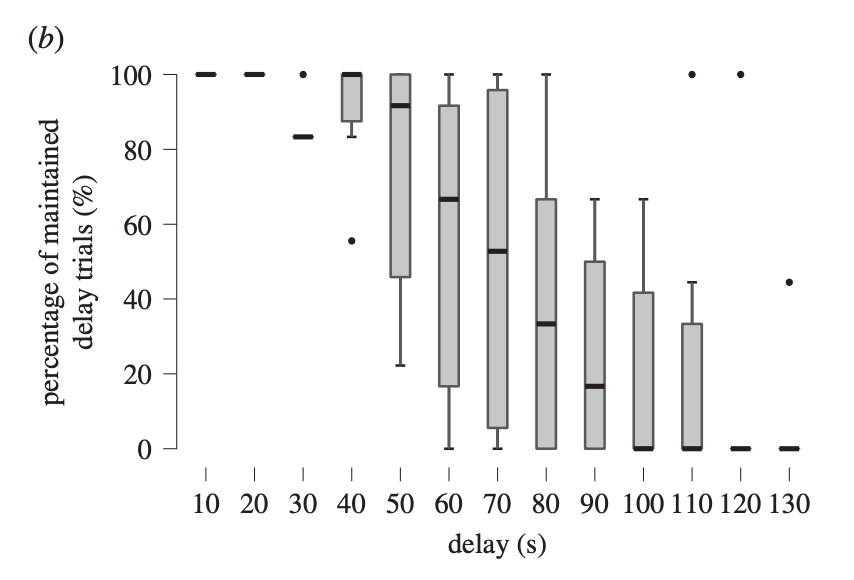
I risultati mostrano che nella condizione sperimentale si verifica una diminuzione significativa della capacità di autocontrollo con l’aumento della durata del ritardo. In particolare, il massimo tempo di attesa varia tra i soggetti, da 50 a 130 secondi.
Gli autori riportano anche che le seppie, come i bambini del Marshmallow Test, sembrano distrarsi, allontanando il corpo dalla preda immediatamente disponibile; per valutare però se tale movimento possa realmente essere una strategia impiegata per distogliere il focus dalla tentazione, occorreranno degli studi più mirati all’osservazione dettagliata di questo comportamento.
I risultati suggeriscono inoltre la presenza di un legame tra autocontrollo e prestazioni cognitive: infatti, gli individui che riescono a resistere per tempi più lunghi, sono anche quelli che ottengono punteggi migliori in un compito di apprendimento. Questo dato riflette quanto è stato evidenziato da precedenti studi nell’uomo e nei primati.
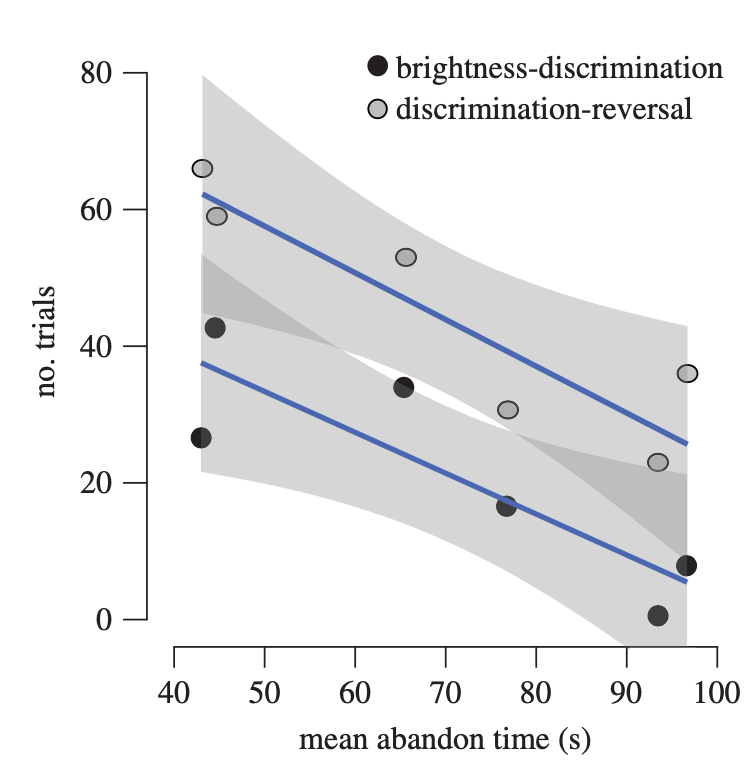
Il self-control e l’apprendimento sono allora forse guidati dagli stessi circuiti neurali?
Nell’essere umano, la capacità di autocontrollo è associata all’attività della corteccia prefrontale. Il sistema nervoso di una seppia è ovviamente molto diverso dal nostro, ma è altrettanto complesso: si sviluppa come dei nuclei centrali e tanti piccoli satelliti distribuiti in tutto il corpo, associati a cromatofori e papille (Reiter et al., 2018). Le aree del sistema nervoso della seppia responsabili del self-control in questo cefalopode non sono ancora state individuate, ma si ipotizza che possano essere le stesse coinvolte nei processi di apprendimento, di decision-making e di inibizione.
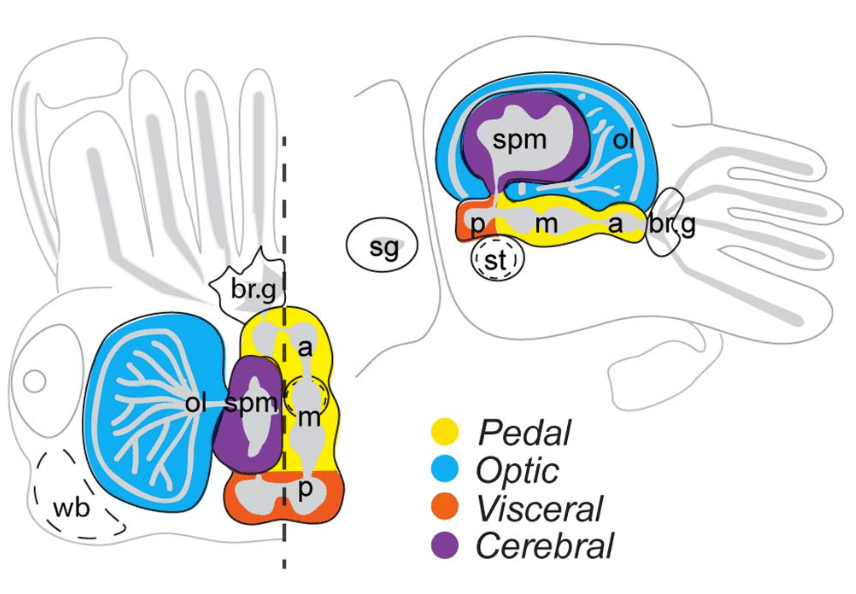
a: massa sottoesofagea anteriore;
br.g: ganglio brachiale;
m: massa sottoesofagea mediana;
ol: lobo ottico;
st: statocisti;
p: massa sottoesofagea posteriore;
sg: ganglio stellato;
spm: massa sopraesofagea;
wb: corpi bianchi.
(Focareta el at., 2014)
Nuovi orizzonti evolutivi dell’autocontrollo
L’aver riscontrato per la prima volta l’autocontrollo in un invertebrato ci mette di fronte all’ipotesi che questa capacità, trasversale a diversi taxa animali, non sia frutto soltanto di fenomeni di convergenza evolutiva (secondo cui alcuni organismi, magari lontani filogeneticamente, svilupperebbero caratteristiche analoghe in risposta a stimoli ambientali simili), ma che possa essere insorta anche sotto pressioni selettive differenti. Nella seppia, ad esempio, potrebbe rappresentare una risposta alla necessità di ottimizzare il comportamento di foraggiamento, durante il quale l’individuo deve restare mimetizzato per lunghi periodi, attendendo il momento più adatto per catturare la preda. Potrebbe essere interessante valutare se questa abilità sia presente anche in altre specie di cefalopodi, che possiedono un sistema nervoso altrettanto complesso e che mostrano tecniche di foraggiamento simili.
Comprendere non solo le cause e l’ontogenesi di un comportamento, ma anche la sua funzione e la sua storia evolutiva, può rappresentare una chiave per capirne le basi neurali e psicobiologiche. Forse, se davvero vogliamo trovare delle tecniche per affinare l’autocontrollo, dovremmo concentrarci proprio su questo aspetto, anziché basarci esclusivamente su quei libri che parlano soltanto di uomini d’affari, di economia e di un modello di H. sapiens completamente snaturalizzato.
Bibliografia:
- Alves C., Boal J.G., Dickel L. (2008) Short-distance navigation in cephalopods: a review and synthesis. Cognitive Processing 9:239-247
- Chiao C., Chubb C., Hanlon R.T. (2007) Interactive effects of size, contrast, intensity and configuration of background objects in evoking disruptive camouflage in cuttlefish. Vision Research 47:2223–2235
- Focareta L., Sesso S., Cole A.G. (2014) Characterization of Homeobox Genes Reveals Sophisticated Regionalization of the Central Nervous System in the European Cuttlefish Sepia officinalis. PLoS ONE 9(10):e109627
- Jozet-Alves C., Bertin M., Clayton N.S. (2013) Evidence of episodic-like memory in cuttlefish. Current Biology 23(23):1033-1035
- Mischel W., Ebbesen E.B. (1970) Attention in delay of gratification. Journal ol Personality and Social Psychology 16(2):329-337
- Omero (VI secolo a.C.) Odissea
- Reiter S., Hülsdunk P., Woo T., Lauterbach M. A., Eberle J. S., Akay L. A., Longo A., Meier-Credo J., Kretschmer F., Langer J. D., Kaschube M., Laurent G. (2018) Elucidating the control and development of skin patterning in cuttlefish. Nature 562:361-366
- Schnell A.K., Boeckle M., Rivera M., Clayton N.S., Hanlon R.T. (2021) Cuttlefish exert self-control in a delay of gratification task. Proceeding of the Royal Society B 288:20203161.
- Shoda Y., Mischel W., Peake P.K. (1990) Predicting adolescent cognitive and self-regulatory competencies from preschool delay of gratification: identifying diagnostic conditions. Developmental Psychology 26(6):978-986

Grazie per aver letto questo articolo!


Finalmente ho trovato il tempo di leggere tutto l’articolo, ricco di spunti.
Probabilmente la cosa funziona in predatori d’agguato e non in calamari, predatori da corsa, in cui non c’è modo né tempo né ragione per tergiversare : ogni sardina è quella buona, potrebbe essere l’ultima.
"Mi piace"Piace a 1 persona
Grazie mille per questo intervento! Chissà, forse i polpi sono dotati di autocontrollo?
"Mi piace""Mi piace"