Le varie funzioni del Sistema Nervoso si basano sulle complesse interazioni tra molteplici circuiti neurali; questi si connettono tra loro in grandi network e il loro funzionamento è responsabile della percezione, della memoria, della cognizione e del comportamento. I vari tipi cellulari che compongono i circuiti neurali possiedono non soltanto morfologie diverse, ma anche proprietà neurofisiologiche e molecolari caratteristiche. Pertanto, comprendere come queste cellule interagiscono, generando differenti pattern di attività neuronale, è fondamentale per elucidare il funzionamento del cervello. Da questa prerogativa nasce la necessità di mappare le cellule nervose e le loro connessioni.
Un metodo che permetta di iniettare in un neurone una sostanza che poi marchi chiaramente tutti i neuroni ad esso collegati, e nessun altro, sarebbe inestimabile.
Francis Crick
E se la sostanza fosse un virus?
Il virus della rabbia (RV), agente eziologico dell’omonima patologia, appartiene al genere Lyssavirus e alla famiglia Rhabdoviridae. Come tutti i virus a RNA a polarità negativa, RV è composto da una molecola di RNA e nucleoproteine, circondate da un rivestimento lipidico (envelope), che deriva dalla membrana della cellula ospite. Il genoma del virus codifica per 5 proteine strutturali:
- Nucleoproteina (N): organizza l’RNA formando con esso un complesso stabile e strettamente avvolto, chiamato ribonucleoproteina (RNP);
- Fosfoproteina (P): fattore della RNA-polimerasi;
- Proteina della matrice (M);
- Glicoproteina (G);
- RNA-polimerasi RNA-dipendente (L).
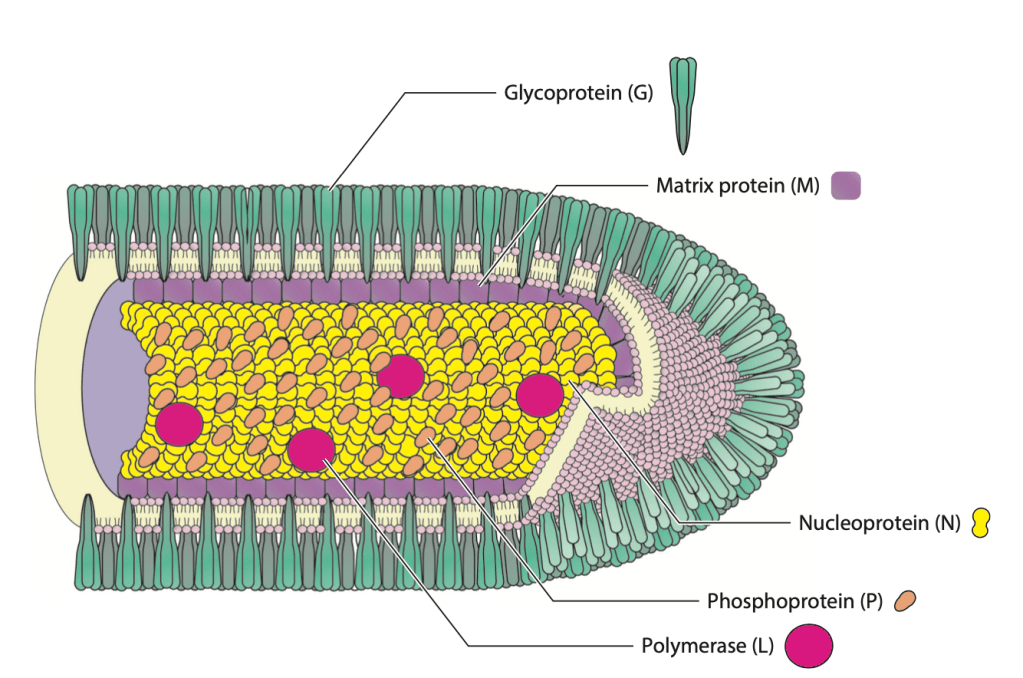
RNP, P ed L sono condensati all’interno di un nucleocapside dalla forma elicoidale. La proteina M circonda il nucleocapside, formando un ponte tra questo e l’envelope. La glicoproteina G, che interagisce con M, è l’unica proteina esposta sul versante esterno dell’envelope ed il suo ruolo è cruciale per l’infezione e la diffusione del virus nell’organismo (se vuoi leggere un esempio più dettagliato, clicca qui). G infatti interagisce coi recettori della cellula ospite, innescando l’endocitosi del nucleocapside nella cellula. Una volta nel citoplasma, L e P utilizzano l’RNA come stampo per una serie di cicli di trascrizione. Le molecole di mRNA prodotte sono poi tradotte in proteina, grazie ai meccanismi di traduzione della cellula ospite. Una volta raggiunti determinati livelli di proteine virali, ha inizio la replicazione del genoma. Vengono quindi generati filamenti di RNA antisenso (a polarità positiva) che serviranno da intermedi per la produzione dell’RNA genomico definitivo. Infine, l’inserzione della proteina G nella membrana cellulare permette, attraverso l’interazione con M, il rilascio del virus di nuova sintesi al di fuori della cellula.
Meccanismo patogenetico
Il virus della rabbia si diffonde nell’organismo secondo una strategia di tipo neuroinvasivo. Solitamente, l’infezione avviene a seguito di una lesione (spesso un morso da parte di un animale infetto) quando le particelle virali entrano a livello della giunzione neuromuscolare. L’endocitosi di RV nella cellula ospite avviene grazie all’interazione tra la proteina G virale e il recettore nicotinico nAchR, situato sulla membrana dei motoneuroni. Una volta che la cellula infetta rilascia il virus, questo viene inglobato dai terminali assonici dei neuroni presinaptici adiacenti. Sfruttando le connessioni tra neurone e neurone, RV risale e si estende alle varie aree del Sistema Nervoso Centrale, secondo un meccanismo di trasporto assonale retrogrado. Il virus infetta quindi i neuroni che proiettano verso la cellula di partenza e si propaga attraverso le connessioni neurali di ordine via via superiore.
Il Sistema Nervoso Centrale dei mammiferi possiede diverse barriere anatomiche e biochimiche che lo separano dal resto del corpo. A livello strutturale, la barriera ematoencefalica regola selettivamente il passaggio di sostanze chimiche da e verso il cervello, proteggendolo da eventi dannosi, quali ad esempio avvelenamenti e intossicazioni. Inoltre, trattandosi di popolazioni di cellule non rinnovabili, i neuroni hanno evoluto meccanismi per proteggersi dagli effetti immunitari, che potrebbero altrimenti riconoscere e distruggere le cellule infette. La modalità di trasporto retrogrado trans-sinaptico, elude i meccanismi protettivi della barriera ematoencefalica. Il virus della rabbia dunque trae un enorme vantaggio dal diffondersi in una rete così connessa di cellule, quali sono i neuroni, in assenza degli effetti citotossici del sistema immunitario.
In una fase successiva, il virus si diffonde con modalità centrifuga in diversi organi extraneurali, compresi la pelle, i follicoli piliferi, il cuore, la lingua e le ghiandole salivari. La presenza del virus RV nel cervello è la principale causa dei tipici cambiamenti comportamentali che facilitano il contagio da un individuo all’altro. Infatti, oltre ai sintomi iniziali aspecifici (febbre, mal di testa, malessere generale), in poco tempo possono insorgere agitazione, idrofobia, aggressività, allucinazioni, perdita del senso dell’orientamento ed eccessiva salivazione.
Un’arma a doppio taglio
È proprio grazie alla tipica diffusione trans-sinaptica retrograda che oggi il virus della rabbia viene sfruttato per mappare le connessioni di neurone-neurone. Allo stesso tempo però, questo tipo di propagazione porta con sé due limitazioni pratiche:
- elevati livelli di replicazione virale sono tossici;
- l’infezione retrograda incontrollata non rivela le connessioni in modo utile, piuttosto marca l’intero cervello.
Per individuare il campo recettivo di uno specifico neurone (o di una popolazione di neuroni) di interesse è necessario quindi modificare il virus, di modo da marcare unicamente le connessioni di primo ordine, rispetto alla cellula di partenza. È possibile infatti eliminare il gene della glicoproteina G dal genoma virale e sostituirlo con un gene codificante per una proteina fluorescente. Questo rende il virus incapace di diffondersi attraverso le sinapsi, ma consente comunque la sua replicazione all’interno della cellula ospite, con conseguente robusta emissione di fluorescenza. Spesso il virus viene inoltre pseudotipizzato (pseudotipizzazione = produzione di vettori virali in combinazione con differenti proteine dell’envelope) con la proteina di rivestimento del virus del sarcoma e della leucosi aviaria, rendendo l’infezione strettamente limitata a quelle cellule che possiedono un recettore (TVA), che normalmente non è espresso nelle cellule dei mammiferi. Di conseguenza, facendo esprimere TVA a determinate cellule, è possibile reindirizzare selettivamente il targeting virale verso una popolazione cellulare geneticamente definita; contemporaneamente, far esprimere a queste medesime cellule la proteina G fornisce al virus la chiave necessaria per il trasporto trans-sinaptico retrogrado (Wickersham et al., 2007).
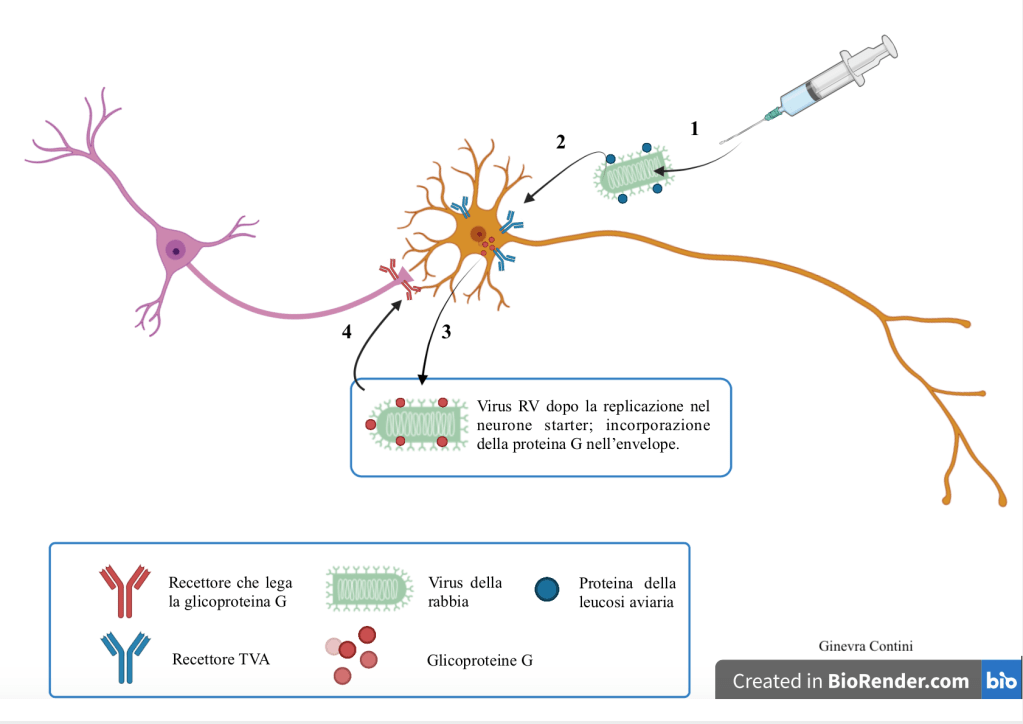
Possiamo riassumere le principali tappe di questo processo nel modo seguente:
- il virus RV viene inoculato;
- RV infetta inizialmente le cellule modificate “starter”, presenti nel sito di iniezione, attraverso i recettori TVA presenti sulla membrana cellulare;
- l’espressione della proteina G nelle cellule starter permette la sua incorporazione nell’envelope del virus (ma non nel suo genoma);
- il virus si diffonde in maniera trans-sinaptica ai neuroni di primo ordine, attraverso l’ingresso mediato dal recettore della proteina G, presente sul terminale assonico;
- il virus RV, privato della glicoproteina, può solo replicarsi nei neuroni di primo ordine;
- è possibile osservare la fluorescenza emessa dai neuroni starter e dalle cellule presinaptiche ad essi interconnesse.
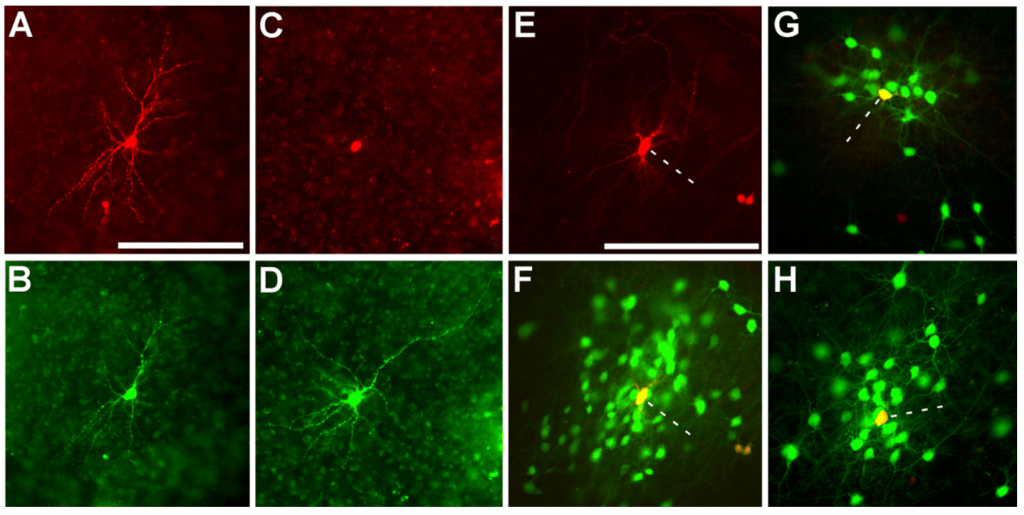
E–H: Diffusione trans-sinaptica ai neuroni di primo ordine. In E la fluorescenza in rosso indica il neurone geneticamente modificato per esprimere TVA e la glicoproteina G, evidenziato con una linea tratteggiata. In F, G ed H è possibile notare l’avvenuta diffusione monosinaptica del virus nei neuroni di primo ordine, attraverso la marcatura fluorescente verde; la cellula starter (linea tratteggiata), inizialmente marcata in rosso, una volta infettata esprime il fluorocromo verde e appare di colore giallo (Wickersham et al., 2007).
Il progresso scientifico nel campo delle neuroscienze ha dunque consentito di trasformare un virus con un tasso di letalità prossimo al 100% in un potente marcatore, che permette di definire in modo univoco le connessioni di differenti popolazioni di neuroni.
Bibliografia:
- Davis B. M., Rall G. F., Schnell M. J. (2015) Everything You Always Wanted to Know About Rabies Virus (But Were Afraid to Ask). Annual Reviews Virology 2:451–71;
- Schwarz M. K., Remy S. (2019) Rabies virus-mediated connectivity tracing from single neurons. Journal of Neuroscience Methods 325:108365;
- Suzuki T., Morimoto N., Akaike A., Osakada F. (2020) Multiplex Neural Circuit Tracing With G-Deleted Rabies Viral Vectors. Frontiers in Neural Circuits 13:77;
- Wickersham I. R., Sullivan H. A., Seung H. S. (2013) Axonal and subcellular labelling using modified rabies viral vectors. Nature Communication 4:2332;
- Wickersham I. R., Lyon D. C., Barnard R. J. O., Mori T., Finke S., Conzelmann K., Young J. A. T., Callaway E. M. (2007) Monosynaptic Restriction of Transsynaptic Tracing from Single, Genetically Targeted Neurons. Neuron 53:639–647.
Scoperto qualcosa di nuovo? Lascia un pollice in sù sotto l’articolo e diffondilo 😉


1 pensiero su “Il virus della rabbia: una matita speciale per colorare le connessioni neuronali”