I meccanismi biologici non sono un qualcosa di cristallizzato e statico nel tempo. Per quanto possiamo sentirci in equilibrio con l’ambiente attorno a noi, esiste una continua dinamicità tra la nostra specie e gli altri organismi (pluricellulari e unicellulari), nello spazio e nel tempo. L’esistenza di questo equilibrio dinamico è evidenziata principalmente da studi ecologici, ma in alcuni casi perfino il nostro organismo può divenire specchio di queste relazioni.
La placenta è un organo deciduo, responsabile dell’ancoraggio dell’embrione all’utero e degli scambi fisiologici tra la madre e il feto. Nonostante il ruolo chiave di questo organo in termini evolutivi, la placenta dei mammiferi è caratterizzata da profonde differenze tra le diverse specie, sia a livello morfologico che fisiologico. Una possibile spiegazione di questo fenomeno è che l’evoluzione della placenta sia stata in parte guidata dall’intervento di antichi retrovirus.
I retrovirus
I retrovirus comprendono tutti i virus con genoma a RNA che possiedono la trascrittasi inversa, un enzima che permette la conversione dell’RNA in DNA, al momento del suo ingresso nel citoplasma della cellula ospite. Il DNA virale è in grado di migrare nel nucleo e di integrarsi nel genoma della cellula, per poi essere trascritto e successivamente tradotto.
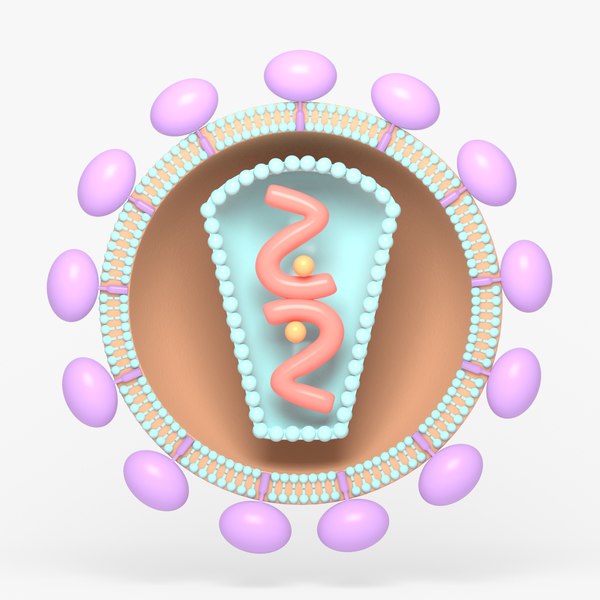
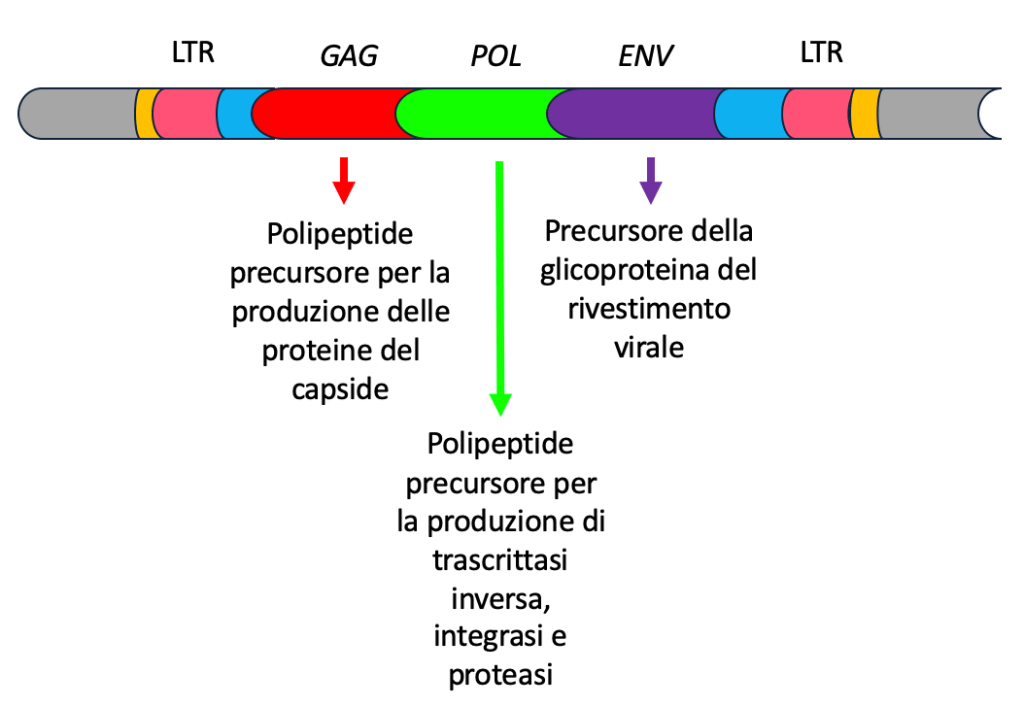
Il genoma dei retrovirus contiene principalmente geni indispensabili per la replicazione del virus (sequenze GAG, POL, ENV), tra cui quelli codificanti per la trascrittasi inversa e l’integrasi, fondamentale per l’integrazione dell’informazione virale nella cellula ospite. A monte e a valle, esistono due sequenze LTR (Long Terminal Repeat), che fungono rispettivamente da promotore e da segnale di poliadenilazione per questi geni.
Una caratteristica della trascrittasi inversa è la mancanza dell’attività di proofreading, la capacità di correzione degli errori durante la sintesi del DNA. Questo comporta un progressivo accumulo di mutazioni, che è alla base della resistenza ai farmaci antivirali e della difficoltà nel trovare dei vaccini efficaci. Per esempio, le molteplici varianti del virus HIV (Human Immunodeficiency Virus), che si generano perfino in uno stesso individuo, rappresentano un ostacolo per il riconoscimento da parte del sistema immunitario e per il brevetto di un vaccino in grado di proteggerci da questo virus in continuo mutamento.
Cosa lega i retrovirus alla placenta umana?
I retrovirus infettano gli organismi vertebrati da oltre 450 milioni di anni, con conseguente integrazione del genoma virale nella cellula ospite. Quando questo processo avviene nelle cellule germinali, i retrovirus possono diventare endogeni, fissandosi nel genoma dell’ospite, e vengono così trasmessi di generazione in generazione. Studi di sequenziamento hanno infatti mostrato che i retrovirus endogeni costituiscono oltre l’8% del genoma umano (Choung, 2018). Nella maggior parte dei casi, i geni retrovirali endogeni non permettono più la replicazione del virus, pertanto non portano uno svantaggio all’organismo ospite. Piuttosto, questa integrazione può rappresentare un evento fortuito se le proteine trascritte dai geni retrovirali consentono lo svolgimento di nuove funzioni biologiche: si parla di domesticazione retrovirale. Ne è un esempio il gene ERVW-1 (che deriva da un gene per la produzione dell’envelope) che codifica per la sincitina-1 (una proteina di fusione cellula-cellula presente nell’uomo e in altri primati, fondamentale per lo sviluppo del sinciziotrofoblasto). Proteine retrovirali simili alla sincitina-1 sono presenti nella placenta di quasi tutti i mammiferi, suggerendo almeno 10 eventi indipendenti di infezione da parte di diversi retrovirus (Chuong, 2018).
Studi funzionali hanno evidenziato che le proteine derivate da retrovirus endogeni tendono a svolgere 3 principali ruoli, a livello della placenta:
- mediazione della fusione cellula-cellula;
- regolazione delle difese immunitarie materne;
- protezione del feto dall’infezione di virus esogeni.
Inoltre, recenti risultati suggeriscono che le sequenze LTR del genoma retrovirale potrebbero essere divenute importanti elementi di regolazione per i geni dell’ospite (Chuong, 2018). Infatti analisi di queste sequenze hanno rivelato che i geni retrovirali endogeni costituiscono una frazione elevata degli elementi regolatori di geni espressi nelle cellule embrionali e placentari, come nel caso del gene che codifica per l’ormone di rilascio della corticotropina (CRH).
CRH è un gene principalmente espresso nel cervello ed è coinvolto nella risposta secondaria allo stress (clicca qui per un esempio). I primati rappresentano l’unico ordine di mammiferi in cui CRH è espresso anche a livello della placenta, dove la produzione dell’ormone aumenta in modo esponenziale durante la gestazione (difetti nella sua regolazione sono associati a parti pre- e post-termine). Pertanto, è facile ipotizzare che l’espressione placentare di CRH sia determinata da una sequenza regolatrice presente esclusivamente nei primati. Negli anni, i ricercatori sono infatti riusciti ad individuare a monte del gene l’inserzione di una sequenza LTR, derivante da un antico retrovirus: transposon-like human element 1B (THE1B) (Dunn-Fletcher et al., 2018). Questa sequenza funge da enhancer, ovvero promuove la trascrizione genica, e si ritiene si sia diffusa nei primati circa 50 milioni di anni fa.

Il potenziale virale
Questi esempi mostrano come non esista un effetto univoco dei fenomeni biologici, soprattutto da un punto di vista evolutivo. Le conseguenze dell’infezione di un organismo da parte di un virus, seppure potenzialmente patogeno, non sono necessariamente negative, ma possono anzi portare un vantaggio per l’ospite, in base al suo background genetico e alle interazioni con i diversi fattori ambientali. Oggi i virus (e le loro capacità di infettare e traferire la propria informazione genetica alle cellule ospiti) sono tra i principali protagonisti dell’ingegneria genetica (clicca qui per un esempio), ma anche delle più moderne tecniche di microscopia (ad esempio è possibile evidenziare le connessioni neurone-neurone grazie al virus della rabbia). I progressi scientifici permetteranno sempre di più di comprendere il ruolo dei virus nell’evoluzione degli organismi ospiti e di individuare meccanismi importanti impiegabili nel campo della ricerca bio-medica.
Bibliografia:
- Chuong E.B. (2018) The placenta goes viral: Retroviruses control gene expression in pregnancy. PLoS Biology 16(10):e3000028.
- Dunn-Fletcher C.E., Muglia L.M., Pavlicev M., Wolf G., Sun M., Hu Y., Huffman E., Tumukuntala S., Thiele K., Mukherjee A., Zoubovsky S., Zhang X., Swaggart K.A., Lamm K.Y.B., Jones H., Macfarlan T.S., Muglia L.J. (2018) Anthropoid primate-specific retroviral element THE1B controls expression of CRH in placenta and alters gestation length. PLoS Biology 16(9):e2006337.

Metti un like per supportare la divulgazione scientifica 😉

